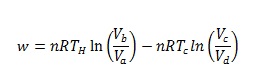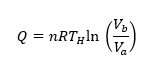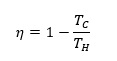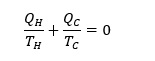Que es el Ciclo de Carnot
EL CICLO DE CARNOT, PROPUESTO POR EL INGENIERO FRANCÉS N. L. SADI CARNOT EN 1824, CONSISTE EN UNA SERIE DE CUATRO PROCESOS REVERSIBLES. YA QUE EL CICLO ES COMPLETAMENTE REVERSIBLE, ES LA FORMA MÁS EFICIENTE DE CONVERTIR EL CALOR PROPORCIONADO AL SISTEMA EN TRABAJO ÚTIL.
Otros ejemplos de ciclos termodinámicos son el ciclo de Brayton, el ciclo de Otto, el ciclo de Diesel, el ciclo de Rankine o el ciclo de Stirling, etc. Todos los ciclos termodinámicos son las versiones idealizadas de los procesos reales y se estudian para comprender los diseños de los sistemas más eficientes.
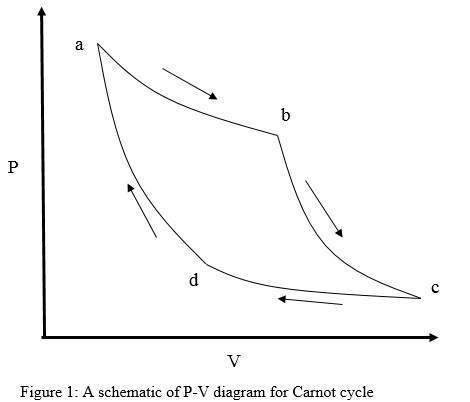
Para el ciclo de Carnot, los cuatro estados termodinámicos en la gráfica de presión-volumen están representados por a, b, c y d(figura 1). El volumen (V) se grafica en el eje X, mientras que la presión (P) se grafica en el eje Y. El ciclo consta de cuatro pasos reversibles:
- a) Expansión isotérmica: con la adición de calor, QH, el sistema se expande y pasa del estado a al b a una temperatura constante, TH. Dado que el proceso es isotérmico, el cambio en la energía interna (ΔU) es cero.
b) Expansión adiabática: el sistema se expande del estado b al c sin intercambio de calor con el entorno, mientras que la temperatura del sistema cambia a TC, donde TC<TH. Como el sistema es reversiblemente adiabático, el cambio de entropía (ΔS) es cero.
c) Compresión isotérmica: con la eliminación del calor, QC, a una temperatura constante TC, el sistema comprime del estado c al d. Dado que el proceso es isotérmico, el cambio en la energía interna (ΔU) es cero.
d) Compresión adiabática: el sistema se comprime de d a a, sin intercambio de calor con el entorno, mientras que la temperatura del sistema aumenta de TC a TH. Nuevamente, ΔS es cero porque es un proceso adiabático reversible.
Utilizando las leyes de los gases ideales, el trabajo total realizado por el sistema (w) se obtiene por
donde n y R son el número de moles de gas y la constante de los gases, respectivamente. El calor proporcionado al sistema (QH) se obtiene por
(3) La eficiencia del ciclo de Carnot (η) se obtiene por
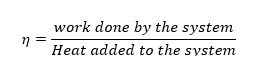
Mediante el uso de (1)-(3) y expresiones de gases ideales para sistemas adiabáticos, se podría deducir que la eficiencia de un sistema se obtiene por (J.M. Smith, 2005)
En consecuencia, cuanto mayor sea la diferencia entre los depósitos de agua caliente y fría, mayor será la eficiencia del ciclo de Carnot. De acuerdo con la segunda ley de la termodinámica, dado que todo el calor agregado al sistema no se puede convertir en trabajo, la eficiencia de cualquier ciclo termodinámico nunca puede ser del 100%. Además, a través de (1)-(3) se puede deducir que
donde QC es negativo ya que es la cantidad de calor liberado.
Además de las suposiciones de la ley de los gas ideales, el ciclo de Carnot descrito anteriormente tiene otras suposiciones, como la ausencia de fricción y de pérdida de calor, la reversibilidad de cada proceso, el depósito de calor infinito, etc. Los procesos reales utilizados en las industrias tienen una eficiencia mucho menor debido a las pérdidas inherentes de energía en el sistema. Por lo tanto, el ciclo ideal de Carnot tiene aplicaciones prácticas limitadas, excepto por proporcionar la máxima eficiencia teórica que logra un sistema. Sin embargo, es importante estudiar el ciclo, ya que sienta las bases de otros ciclos termodinámicos que tienen numerosas aplicaciones en las industrias. Dos de las aplicaciones del ciclo se describen aquí: la máquina de Carnot y la refrigeración.
Máquina de Carnot
La máquina de Carnot es un motor térmico hipotético diseñado en función del ciclo de Carnot en el que el calor suministrado a un sistema se utiliza para obtener trabajo mecánico útil. Según el ciclo de Carnot descrito anteriormente, el calor producido se utiliza para mover mecánicamente un pistón que, a su vez, se conecta a una biela para producir el movimiento.
Al maximizar la conversión de calor en trabajo mecánico, el motor de Carnot demuestra conceptualmente el límite superior de lo que se puede lograr en términos de eficiencia térmica.
Refrigeración
La refrigeración es un método para eliminar el calor de un ambiente a baja temperatura y disiparlo en otro ambiente a una temperatura más alta. Como se ha mencionado anteriormente, involucra cuatro procesos termodinámicos que constituyen un ciclo. Dado que estos procesos son reversibles, es posible recorrer el ciclo en sentido inverso. Se compone de cuatro unidades principales: una válvula reguladora, un evaporador, un compresor y un condensador. Un líquido a alta temperatura y alta presión pasa a través de una válvula reguladora que reduce su presión y temperatura. El líquido frío pasa a través del ambiente para ser refrigerado donde absorbe calor del ambiente y se transforma en vapor. En este proceso, el fluido en circulación absorbe el calor latente del ambiente para vaporizarse. Después de producir el efecto de enfriamiento deseado, el vapor pasa a través de un compresor donde se comprime en vapor a alta presión y alta temperatura. El último paso es convertir el vapor de nuevo en líquido, lo cual se realiza fuera del refrigerador donde el calor se disipa en los alrededores (atmósfera) y el vapor se condensa nuevamente para transformarse en líquido. La alta temperatura utilizada para calcular la eficiencia máxima de Carnot en este simple ciclo de refrigeración será la temperatura atmosférica. En este proceso, el calor latente de vaporización se elimina del fluido en circulación. El ciclo se completa después de que este líquido a alta presión se alimenta a la válvula de regulación. El principio de refrigeración se utiliza en industrias o en hogares para construir refrigeradores y acondicionadores de aire.
J.M. Smith, H. V. (2005). Introducción a la termodinámica en ingeniería química. Nueva York: McGraw Hill.